अभ्यास के प्रश्नों के उत्तर
(a) NaCl विलयन एवं कॉपर धातु
(b) MgCI2 विलयन एवं एलुमीनियम धातु
(c) FeSO4 विलयन एवं सिल्वर धातु
(d) AgNO3 विलयन एवं कॉपर धातु
(a) ग्रीज़ लगाकर
(b) पेंट लगाकर
(c) जिंक की परत लगाकर
(d) ऊपर के सभी।
(a) कैल्सियम
(b) कार्बन
(c) सिलिकॉन
(d) लोहा।
(a) टिन की अपेक्षा जिंक महंगा है।
(b) टिन की अपेक्षा जिंक का गलनांक अधिक है।
(c) टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है।
(d) टिन की अपेक्षा जिंक कम अभिक्रियाशील है।
(a) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों के बीच आप विभेद कैसे कर सकते हैं ?
(b) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिता का अवलोकन करें।
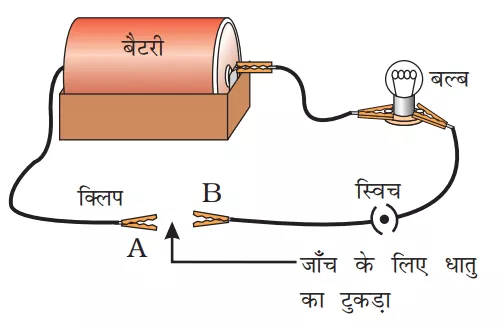
(ii) सभी उपकरणों को दर्शाए गए चित्र के अनुसार जोड़ लेंl लिए गए नमूनों को क्लिप्स के बीच में रखें और स्विच ‘ऑन’ करेंl यदि बल्ब जलता है तो नमूना धातु है क्योंकि धातु विद्युत् का सुचालक होते हैं और यदि बल्ब नहीं जला तो लिया गया नमूना अधातु है क्यूंकि अधातु विद्युत् के कुचालक होते हैंl
 (b) लोहे के आघातवर्ध्य होने के कारण, एवं लगभग सभी धातुओं के आघातवर्ध्य गुण के कारण उन्हें पतली चादर के रूप में बदल कर विभिन्न कामों के लिए प्रयोग में लाया जा सकता हैl जैसे लोहे का प्रयोग बक्से एवं संदूक बनाने में किया जाता हैl
(b) लोहे के आघातवर्ध्य होने के कारण, एवं लगभग सभी धातुओं के आघातवर्ध्य गुण के कारण उन्हें पतली चादर के रूप में बदल कर विभिन्न कामों के लिए प्रयोग में लाया जा सकता हैl जैसे लोहे का प्रयोग बक्से एवं संदूक बनाने में किया जाता हैl
धातुएँ विद्युत कि सुचालक होती हैंl इसी गुण के कारण कॉपर एवं ऐलुमिनियम को विद्युत के संचालन के लिए प्रयोग किया जाता हैl
उदाहरण: ऐलुमिनियम ऑक्साइड (Al2O3) ज़िंक ऑक्साइड (ZnO)
(i) Al2O3+ 6HCl → 2AlCl3+ 3H2O ( क्षारीय व्यवहार )
Al2O3+ 2NaOH → 2NaAlO2+ H2O ( अम्लीय व्यवहार )
(ii) ZnO + 2HCl → ZnCl2+ H2O ( क्षारीय व्यवहार )
ZnO + 2NaOH → Na2ZnO2+ H2O ( अम्लीय व्यवहार )
(ii) कॉपर (Cu) तथा पारा (Hg) हाइड्रोजन से कम अभिक्रियाशील होने के कारण ऐसा नहीं कर सकतेl
प्रश्न 8. किसी धातु M के विद्युत् अपघटनी परिष्करण में आप एनोड-कैथोड एवं विद्युत् अपघट्य किसे बनाएँगे ?
उत्तर-एनोड-धातु M की अशुद्ध मोटी प्लेट।
कैथोड-धातु M की शुद्ध पतली प्लेट।
अपघट्य-धातु M का जल में घुलनशील विलयन।
(a) गैस की क्रिया क्या होगी ?
(i) सूखे लिटमस पत्र पर
(ii) आर्द्र लिटमस पत्र पर।
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखिए।
S (s) + O2→ SO2
(i) सूखे लिटमस पत्र पर गैस की कोई भी क्रिया नहीं होगीl
(ii) सल्फ़र एक अधातु है और अधातु की प्रकृति अम्लीय होती है गैस गैस आर्द्र लिटमस पत्र में मौजूद जल के साथ अभिक्रिया क्र सल्फ्यूरिक अम्ल उतपन्न करेगी जो नीले लिटमस पत्र का रंग लाल कर देगाl
(b) SO2(g) + H2O → H2SO3(aq)
2. एनेमल से- लोहे की सतह पर रंग-रोगन की तह जमाकर जंग लगने पर नियंत्रण पाया जाता है बसों, कारों, स्कूटर-मोटर साइकिल, खिड़कियों, रेलगाड़ियों आदि पर एनेमल की तह ही जमाई जाती है
(i)अम्लीय ऑक्साइड– अधातुएँ ऑक्सीजन से संयोग करके सह-संयोजक ऑक्साइड बनाती हैं जो पानी में घुलकर अम्ल बनाते हैंl
(a) C + O2 → CO2
CO2 + H2O → H2CO3 (कार्बोनिक अम्ल)
(b) S + O2 → SO2
SO2 + H2O → H2SO3
(ii)उदासीन ऑक्साइड– कुछ अधातुएँ ऑक्सीजन से संयोग करके उदासीन ऑक्साइड बनाती हैंl इन पर लिटमस पेपर का कोई प्रभाव नहीं होता है जैसे- कार्बन मोनो-ऑक्साइड (CO), पानी (H2O) तथा नाइट्रस ऑक्साइड (NO2) उदासीन ऑक्साइड हैंl
(a) प्लैटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है
(b) सोडियम, पोटैशियम एवं लीथियम को तेल के अंदर संग्रहित किया जाता है
(c) एलुमिनियम अत्यंत अभिक्रियाशील धातु है फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने में किया जाता है
(d) निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है
(b) सोडियम, पोटैशियम एवं लिथियम अत्यधिक अभिक्रियाशील है ये ऑक्सीजन के साथ मिलकर ऑक्साइड बनाते हैं तथा जल के संपर्क में आने पर जल जाते हैं इसलिए इन्हे बचाने के लिए तेल में डुबोकर रखा जाता हैl
(c) एलुमिनियम एक शक्तिशाली एवं सस्ता धातु है .ऐलुमिनियम के बर्तन आसानी से संक्षारित नहीं होते अतः यह ऊष्मा के सुचालक है
(घ) धातुओ को उनके ऑक्साइड से पृथक करना ज्यादा आसान प्रक्रिया है अतः निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
(i) धातुए क्षारकीय ऑक्साइड बनाती है |
(ii) धातु अपचायक होती है |
(iii) धातुए जल से हाइड्रोजन को विस्थापित कर देती है |
अधातु के रासायनिक गुणधर्म :
(i) अधातुए अम्लीय या उदासीन ऑक्साइड बनाती है |
(ii) अधातु उपचायक होती है |
(iii) अधातुए जल से हाइड्रोजन को विस्थापित नहीं कर पाती है
3Fe (s) + 4H2O → Fe3O4(s) + 4H2(g)
इस पोस्ट में आपको धातु और अधातु Class 10 Notes PDF धातु और अधातु class 10 महत्वपूर्ण सवाल धातु एवं अधातु धातु और अधातु के बीच का अंतर धातु और अधातु pdf साइंस नोट्स फॉर क्लास १० इन हिंदी साइंस क्लास १० नोट्स NCERT Solutions of Science in Hindi for Class 10th: Ch 3 धातु एवं अधातु class 10 science chapter 3 notes in hindi class 10 science notes in hindi chapter 3 से संबंधित पूरी जानकारी दी गई है अगर इसके बारे में आपका कोई भी सवाल या सुझाव हो तो नीचे कमेंट करके हम से जरूर पूछें और अगर आपको यह जानकारी फायदेमंद लगे तो अपने दोस्तों के साथ शेयर जरूर करें.
NCERT Solutions for Class 10 Science (Hindi Medium)
- Class 10th Science Chapter 1 – रासायनिक अभिक्रियाएँ एवं समीकरण
- Class 10th Science Chapter 2 – अम्ल, क्षार एवं लवण
- Class 10th Science Chapter 3 – धातु और अधातु
- Class 10th Science Chapter 4 – कार्बन और उसके यौगिक
- Class 10th Science Chapter 5 – तत्वों का आवर्त वर्गीकरण
- Class 10th Science Chapter 6 – जैव प्रक्रम
- Class 10th Science Chapter 7 – नियंत्रण एवं समन्वय
- Class 10th Science Chapter 8 – जीव जनन कैसे करते है
- Class 10th Science Chapter 9 – आनुवंशिकता एवं जैव विकास
- Class 10th Science Chapter 10 – प्रकाश – परावर्तन तथा अपवर्तन
Class 10th Science Chapter 11 – मानव नेत्र तथा रंगबिरंगा संसार - Class 10th Science Chapter 12 – विद्युत (Electricity)
- Class 10th Science Chapter 13 – विधुत धारा के चुंबकीय प्रभाव
- Class 10th Science Chapter 14 – ऊर्जा के स्रोत
- Class 10th Science Chapter 15 – हमारा पर्यावरण
- Class 10th Science Chapter 16 – प्राकृतिक संसाधनों का प्रबंधन